PROCESOS TERMODINÁMICOS
Procesos termodinámicos
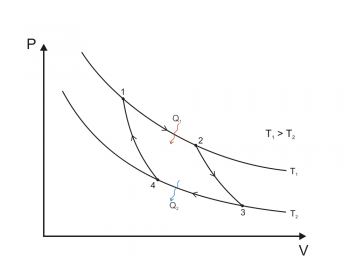
En física, se denomina proceso termodinámico a la evolución de determinadas magnitudes (o propiedades) propiamente termodinámicas relativas a un determinado sistema termodinámico. Desde el punto de vista de la termodinámica, estas transformaciones deben transcurrir desde un estado de equilibrio inicial a otro final; es decir, que las magnitudes que sufren una variación al pasar de un estado a otro deben estar perfectamente definidas en dichos estados inicial y final.
De esta forma los procesos termodinámicos pueden ser interpretados como el resultado de la interacción de un sistema con otro tras ser eliminada alguna ligadura entre ellos, de forma que finalmente los sistemas se encuentren en equilibrio (mecánico, térmico y/o material) entre sí.
De una manera menos abstracta, un proceso termodinámico puede ser visto como los cambios de un sistema, desde unas condiciones iniciales hasta otras condiciones finales, debido a su desestabilización.
Un sistema termodinámico está en principio en un estado de equilibrio termodinámico cuando las variables principales del sistema (es decir, presión, volumen y temperatura) no experimentan ninguna variación adicional con el paso del tiempo.
En el caso de que dos o todas las variables anteriores cambien (la variación de solo una de ellas es imposible porque todas están interconectadas por una razón de proporción inversa o directa) estamos en presencia de una transformación termodinámica, que lleva al sistema hacia una otro punto de equilibrio.
El estado inicial y final de una transformación se identifican por dos pares de valores de las tres cantidades que definen el estado de un cuerpo: presión, volumen o temperatura.
Una transformación termodinámica puede tener lugar:
- Intercambiando trabajo , pero sin intercambios de calor (para un sistema adiabático : transformación adiabática )
- Intercambiando calor , pero sin intercambiar trabajo ; (por ejemplo, para una transformación isocora)
- Intercambiando trabajo y calor (por ejemplo, para una transformación isobárica o una isoterma )
Una transformación termodinámica puede ser reversible o irreversible. Todas las transformaciones reales son irreversibles, ya que las fricciones no se pueden eliminar por completo, por lo que la condición de reversibilidad es solo una aproximación teórica.
Los procesos más importantes de transformación termodinámica son los siguientes:
Procesos isotérmicos
Los procesos isotérmicos son procesos en los que la temperatura no cambia.
Un proceso isotérmico es una transformación de un sistema en la que la temperatura permanece constante: Δ T = 0. Esto sucede cuando el sistema está en contacto con una fuente exterior capaz de canjear calor con el sistema (cediendo o aportando calor) y el sistema evoluciona muy lentamente permitiendo que la temperatura interior se iguale a la temperatura exterior (mediante la transmisión de calor en el sentido adecuado: de la parte más caliente a la más fría).
En un proceso adiabático pasa exactamente lo contrario. No hay transmisión de calor (Q = 0).
Procesos isobáricos
Los procesos isobáricos son procesos en los cuales la presión no varía. Dicho de otra manera, un proceso isobárico es una transformación termodinámica que se produce a presión constante.
Cuando un gas perfecto evoluciona isobáricamente desde un estado A hasta un estado B, la temperatura y el volumen asociados siguen la ley de Charles
Procesos isocóricos
Los procesos isocóricos son procesos en los que el volumen permanece constante.
Un proceso isocórico, también llamado proceso isométrico o isovolumétrico es un proceso termodinámico en el cual el volumen permanece constante. Esto implica que el proceso no realiza trabajo presión-volumen.
Procesos adiabáticos
Los procesos adiabáticos son procesos en los que no hay transferencia de calor alguna.
Un proceso adiabático es aquel en el que el sistema (generalmente, un fluido que realiza un no intercambia calor con su entorno. Un proceso adiabático que es, además, reversible, es un proceso isentrópico.
El extremo opuesto, en el que tiene lugar la máxima transferencia de calor, causando que la temperatura permanezca constante, se denomina proceso isotérmico. El término adiabático hace referencia a elementos que impiden la transferencia de calor con el entorno. Una pared aislada se aproxima bastante a un límite adiabático.
Otro ejemplo es la temperatura adiabática de llama, que es la temperatura que podría alcanzar una llama si no hubiera pérdida de calor hacia el entorno. En climatización, los procesos de humectación (aporte de vapor de agua) son adiabáticos, ya que no hay transferencia de calor, a pesar de que se consiga variar la temperatura del aire y su humedad relativa.
El calentamiento y enfriamiento adiabático son procesos que comúnmente ocurren debido al cambio en la presión de un gas. Esto puede ser cuantificado usando la ley de los gases ideales.
Procesos diatérmicos
Los procesos diatérmicos son procesos que dejan pasar el calor fácilmente.
Procesos isoentrópicos
Los procesos isoentrópicos son procesos adiabáticos y reversibles. Procesos en los que la entropía no varía.
En termodinámica, un proceso isentrópico, a veces llamado proceso isoentrópico, es aquel en el que la entropía del fluido que forma el sistema permanece constante.
Comentarios
Publicar un comentario